 TuttoChimica.it
TuttoChimica.it
Chimica, laboratorio e dintorni...

Traduzione del DNA
Traduzione del DNA in eucarioti e procarioti
La traduzione è il processo mediante il quale l'mRNA, ottenuto dal DNA nella fase di trascrizione assieme agli rRNA e ai tRNA, viene espresso in proteine, ossia l'informazione genetica dal DNA viene decodificata su specifici apparati proteici, i ribosomi, per ottenere la sintesi di proteine.
Apparato di traduzione: i ribosomi e i tRNA
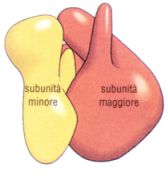
I ribosomi sono complessi formati da proteine e rRNA (RNA Ribosomiale), di diametro circa 20-30 nm, costituiti in eucarioti e procarioti da 2 subunità proteiche indicate con L e S (large e small). Le proteine che costituiscono la subunità minore sono indicate con S e quelle della subunità maggiore con L. Le subunità nei procarioti sono indicate rispettivamente con le sigle 30S e 50S (S indica una misura di sedimentazione (Svedberg) che dipende dal peso della subunità). Alla subunità 30S troviamo legato l'rRNA 16S mentre legati alla 50S gli rRNA 23S e 5S.
Analogamente negli eucarioti abbiamo una subunità minore (40S) e una maggiore (60S), cui si legano rispettivamente gli rRNA 18S per la minore, e 28S, 5.8S e 5S per la maggiore.
Rilevante importanza nell'unione delle 2 subunità dei ribosomi sembra avere lo ione Magnesio.
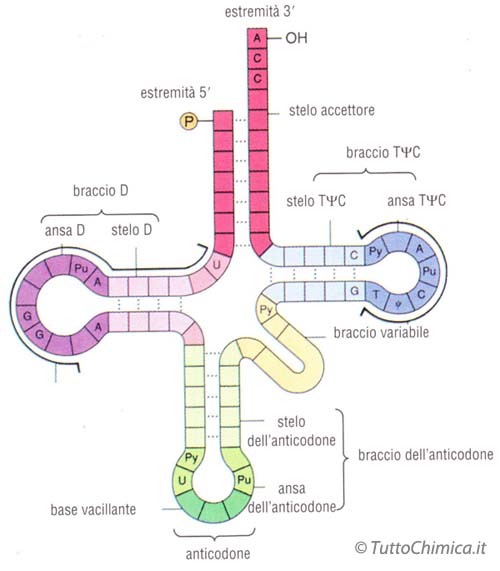
I tRNA (RNA transfer) vengono rappresentati con una forma a trifoglio, sia in eucarioti che in procarioti. L'estremità 3', che termina con CCA, è definita sito accettore in quanto lega l'amminoacido il cui gruppo carbossilico forma un legame estere con l'OH 3' del tRNA. Il braccio o ansa TψC interagisce con l'rRNA 5S della subunità maggiore del ribosoma per direzionare e legare il tRNA. Il braccio variabile serve invece a mantenere costanti le dimensioni dei vari tRNA, e può variare fino a una ventina di nucleotidi.
L'ansa dell'anticodone è molto importante in quanto contiene 3 nucleotidi (definiti appunto anticodone) che saranno complementari a 3 nucleotidi sulla sequenza di mRNA.
Infine il braccio D, contenente diidrouracile.
Il codice genetico è l'insieme dei codoni e anticodoni che permettono di 'convertire' tra DNA e amminoacidi, e quindi proteine. Esistono 20 amminoacidi in natura, e ogni amminoacido è codificato da una (o più) triplette di nucleotidi sul mRNA. Essendovi 4 nucleotidi differenti sul mRNA (A, U, C, G) e 3 sono i nucleotidi in ogni tripletta, avremo in tutto 43=64 possibili combinazioni di triplette. Quindi ogni tripletta può codificare per uno o più amminoacidi, inoltre troviamo alcuni codoni definiti di stop (o non senso) che servono per terminare la traduzione del filamento di mRNA. I codoni non senso sono UAA, UAG e UGA.
Poichè gli amminoacidi sono identificati dai loro specifici anticodoni, è necessario che si leghino al relativo tRNA. Questo avviene ad opera di enzimi detti amminoacil-tRNA-sintetasi, vi è uno di questi enzimi per ogni amminoacido e consente il legame dell'amminoacido sull'estremità 3' del tRNA, con consumo da parte dell'enzima di ATP come fonte di energia.
Traduzione nei Procarioti e negli Eucarioti
La subunità minore, in particolare grazie al rRNA 16S, si lega all'mRNA vicino al punto di inizio traduzione (sequenza di inizio AUG o talvolta GUG). Grazie anche a fattori di inizio (IF1 e IF3) l'mRNA si stabilisce su due siti attivi del ribosoma, il sito P e il sito A, contigui tra loro e su cui si verranno a trovare quindi due triplette consecutive dell'mRNA. Sul sito P si verrà a trovare la tripletta (codone) di inizio, la tripletta AUG che codifica per la formil-metionina. Il sito A resta inizialmente vuoto. Arriva a quel punto, legato al suo tRNA, l'amminiacil-tRNA relativo alla tripletta che si trova sul sito A. Il nuovo tRNA si stabilizza grazie all'ansa TψC e al legame tra codone e anticodone, mentre sulla subunità maggiore avviene la formazione del legame peptidico tra i primi due amminoacidi (grazie al centro peptidil-transferasico della subunità maggiore che catalizza il legame peptidico), con legame tra il COOH dell'amminoacido sul sito P e il gruppo NH2 dell'amminoacido legato al tRNA sul sito A. L'allungamento della catena peptidica avviene quindi in direzione NH2 --> COOH.
A questo punto l'mRNA slitta di una tripletta grazie a fattori di allungamento, l'amminoacil-tRNA che era sul sito A si sposta sul sito P e sul sito A giunge un nuovo tRNA, complementare come codone-anticodone con la tripletta sull'mRNA del sito A. Il tRNA che era sul sito P esce fuori dal complesso ribosomiale staccandosi dal suo amminoacido, sempre grazie a fattori di allungamento. E la sintesi del filamento peptidico nascente continua, un amminoacido dopo l'altro, fino a comparsa di fattori di rilascio (RF1, RF2 e RF3) attivati dai codoni non senso, che rompono il legame con il tRNA e liberano nel citoplasma la neonata catena peptidica.
I ribosomi possono essere numerosi e consecutivi, e legare lo stesso filamento di mRNA man mano che avanza, per una produzione della stessa proteina a catena.
Negli eucarioti le differenze sono numerose riguardanti i fattori di inizio e di allungamento. Si può riscontrare inoltre, oltre al sito P e al sito A, un sito R e un sito E. Il sito R è implicato con l'iniziale aggancio dei amminoacil-tRNA perchè poi possano essere ben posizionati sul sito A, il sito E rappresenta invece il sito attraverso il quale i tRNA senza più l'amminoacido attaccato si staccano dai ribosomi.
Come infine si può facilmente notare, il peso di una proteina, paragonato a quello del gene da cui essa deriva, è molto inferiore, in quanto un nucleotide pesa molto più di un amminoacido, e per ottenere un amminoacido occorrono ben 3 nucleotidi (per via del già citato meccanismo di lettura a triplette).
Categorie Articoli e Appunti
• Chimica Generale
•
Chimica Analitica
•
Chimica Inorganica
•
Chimica Organica
•
Biochimica
•
Biologia
•
Genetica