 TuttoChimica.it
TuttoChimica.it
Chimica, laboratorio e dintorni...

Le proteine
Struttura e caratteristiche
Le proteine rappresentano una ampia classe, per varietà e funzioni,
di macromolecole biologiche.
Alcune delle principali funzioni che le proteine possono ricoprire:
1. Sono proteine gli Enzimi, una particolare tipologia di proteine che fungono da catalizzatori in reazioni biochimiche, accelerando specifiche reazioni o addirittura consentendo alcune reazioni all'interno della materia vivente.
2. Proteine strutturali, costituiscono l'ossatura delle cellule (il citosceletro) e anche molte strutture extra-cellulari.
3. Possono regolare l'espressione genica. Alcune proteine sono infatti dette fattori di trascrizione, che riconoscono specifiche sequenza sul DNA e ne favoriscono o ne inibiscono l'espressione.
4. Le proteine contrattili, responsabili della capacità di movimento delle cellule.
5. I canali ionici, o pompe ioniche, e le proteine di trasporto, sono proteine che attraversano la membrana cellulare e mantengono un gradiente di concentrazione ionico intra-extra cellulare (permettendo anche nelle cellule nervose la differentza di potenziale dentro-fuori cellula) oppure permettono l'ingresso di sostanze (ioni specifici o nutrienti) nella cellula, anche contro gradiente di concentrazione.
6. La maggior parte dei recettori cellulari sono proteine: questi, site nella parte esterna della membrana, riconoscono ormoni e fattori di crescita per la cellula, modificandone il funzionamento.
7. Alcune proteine possono fungere da ormoni e da fattori di crescita, cioè composti che, immessi nella cricolazione sanguigna, possono regolare la crescita di altri tessuti e cellule.
8. Altre protine possono costituire una riserva energetica: sono le proteine di deposito;
9. Gli anticorpi sono altre proteine, che riconoscono le sostanze estranee al nostro corpo e attivano le difese immunitarie;
10. Alcune proteine del regno animale sono tossine.
Struttura chimica delle proteine:
Le proteine sono dei polimeri, costituiti da una sequenza di 20 differenti alfa-amminoacidi che si susseguono in un filamento, legati tra loro da legami covalenti. La sintesi delle proteine avviene, all'interno delle cellule, nei ribosomi, organuli cellulari deputati all'assemblaggio proteico nella fase di traduzione del DNA. Le proteine costituite essenzialmente da amminoacidi sono dette proteine semplici, quelle che oltre agli amminoacidi presentano, legati alla catena amminoacidica tramite legami covalenti o legami secondari, gruppi differenti, sono dette proteine coniugate.
Gli alfa-amminoacidi sono costituiti da un Carbonio centrale (detto carbonio alfa) al quale sono legati covalentemente 4 gruppi differenti. Il C alfa è quindi asimmetrco (chirale, dà origine a stereoisomeria). Gli ammminoacidi che cosituiscono le proteine sono sempre L-amminoacidi, e differiscono tra loro per il gruppo R (catena laterale).
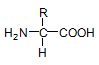
E' possibile classificare gli amminoacidi in base alla loro polarità. Distinguiamo:
Amminoacidi apolari (glicina, alanina, valina, leucina, isoleucina, cisteina, metionina, fenilalanina, triptofano, prolina)
Amminoacidi polari (serina, treonina, tirosina, asparagina, glutammina)
Amminoacidi ionizzabili (acido aspartico, acido glutammico, lisina, arginina, istidina)
Gli amminoacidi si legano fra loro con un legame detto legame peptidico (da cui deriva il termine catena peptidica ad indicare la catena di amminoacidi che costituisce la proteina)
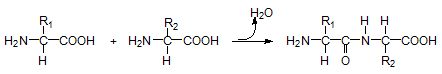
Le due estremità della catena che terminano con un gruppo amminico e con un carbossile sono dette rispettivamente N-terminale e C-terminale. Per convenzione, la sequenza di amminoacidi di una proteina è letta sempre dall'estremità N-terminale alla C-terminale.
Gli amminoacidi acidi e basici conferiscono proprietà acido-base alle proteine: infatti sui gruppi laterali R degli amminoacidi acidi e basici espongono gruppi COOH e NH2 che danno proprietà anfotere alle proteine, ossia le proteine, avendo amminoacidi acidi e basici, possono comportarsi da acidi o da basi a seconda dell'ambiente in cui sono poste. Ad un pH neutro (pH 7), i gruppi acidi e basici sono ionizzati, per cui la carica della proteina sarà data dalla somma algebrica delle cariche positive e negative conferite da tali gruppi. Se il pH aumenta, diminuirà il numero di gruppi carbossilici dissociati, per cui diminuisce il numero di cariche negative sulla proteina, mentre il numero di cariche positive resta inalterato; viceversa all'aumentare del pH diminuisce il numero di cariche positive. A seconda degli amminoacidi che costituiscono la proteina, ci sarà un pH tale per cui il numero di cariche positive eguaglia quello delle cariche negative: questo pH è detto punto isoelettrico della proteina, ed è specifico a seconda della proteina e dei suoi amminoacidi costituenti. Al punto isoelettrico le proteine presentano la minima solubilità, in quanto avendo carica complessiva nulla non si respingono tra loro e tendono ad aggregarsi più facilmente.
Struttura tridimensionale delle proteine
Per descrivere la struttura proteica si parla di struttura primaria, secondaria, terziaria e quaternaria di una proteina:
La struttura primaria è essenzialmente la sequenza degli amminoacidi costituenti la proteina, legati tra loro con legame peptidico e letti dall'estremità N-terminale alla C-terminale.
Si parla inoltre di strutture secondarie (una o più all'interno della stessa poteina), tratti di struttura primaria che, nello spazio, assumono una disposizione ripetitiva e regolare, stabilizzate da legami a idrogeno e interazioni deboli tra l'idrogeno del gruppo NH e l'ossigeno del gruppo carbonilico CO dei legami peptidici di differenti punti della sequenza. Le strutture secondarie più diffuse sono le alfa eliche e i foglietti beta: nella alfa-elica, la sequenza di amminoacidi si avvolge a spirale (in senso destrogiro solitamente) in modo da portare i gruppi CO di ogni legame peptidico al di sopra del gruppo NH del terzo legame peptidico che lo precede nella sequenza, in modo da stabilizzare la struttura con i legami deboli tra questi gruppi. Il foglietto beta invecesi forma tra catene amminoacidiche della proteina parallele tra loro e sullo stesso piano, a formare un vero e proprio foglietto: anche in questo caso i legami sono tra i gruppi CO ed NH ma si formano tra le catene parallele tra loro.
La struttura terziaria della proteina invece è data dal modo in cui la proteina si 'raggomitola' su sè stessa, nella posizione a migliore stabilità (a minore energia). In questa struttura si formano ulteriori interazioni deboli tra le diverse strutture secondarie costituenti la proteina. A volte, in alcune proteine, possono formarsi anche dei legami covalenti -S-S- (ponti disolfuro) tra gruppi tiolici di cisteine su strutture secondarie differenti. La struttura terziaria varia anche a seconda dell'ambiente idrofilo/idrofobo in cui la proteina viene a trovarsi: le proteine, se poste in un liquido idrofilo come l'acqua, tenderanno a ripiegarsi esponendo al loro interno i gruppi idrofobi e all'esterno i gruppi più idrofili.
La struttura quaternaria si osserva nelle proteine costituite da più catene peptidiche separate tra loro a formare rispettive strutture terziarie, che si uniscono nella maniera più stabile a dare la struttura finale della proteina. Ogni struttura terziaria in questo caso dà origine ad una subunità proteica. Le subunità possono essere tra loro identiche, oppure differenti, a seconda della catena peptidica di partenza.
Categorie Articoli e Appunti
• Chimica Generale
•
Chimica Analitica
•
Chimica Inorganica
•
Chimica Organica
•
Biochimica
•
Biologia
•
Genetica