 TuttoChimica.it
TuttoChimica.it
Chimica, laboratorio e dintorni...

Determinazione della concentrazione proteica totale di un campione
Metodo del biureto
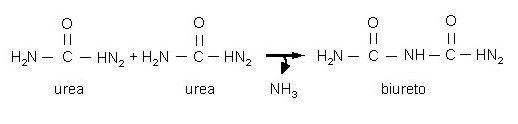
Il Biureto è un’ammide che si ottiene per condensazione, a 180°C, di due molecole di urea con l’eliminazione di una molecola di NH3. Il biureto in soluzione alcalina forma con gli ioni Cu2+ un complesso di colore violetto (reazione del biureto).
È stato osservato che questa reazione non è specifica solo del biureto, ma gli ioni Cu2+, in ambiente basico, reagiscono con qualsiasi composto contenente almeno 2 gruppi CONH2 , CH2NH2 o CSNH2.
Poiché la reazione richiede la presenza di due gruppi CONH2, questa è negativa con gli amminoacidi e con i dipeptidi mentre è positiva con i polipeptidi a partire dai tripeptidi, e quindi anche con le proteine.
Il Cu in soluzione alcalina però è instabile perché precipitano i sali di rame come Cu(OH)2. Quindi per stabilizzare i sali di Cu, Weichselbaum (1950) propose un reattivo contenente tartrato di sodio e potassio (sale di Seignette) e KI per impedirne l’autoriduzione.
L’intensità del colore è proporzionale al numero di legami peptidici interessati nella reazione. L’intensità del colore prodotto dalla reazione è proporzionale quindi anche alla concentrazione delle proteine, che potrà essere valutata per via spettrofotometrica (il complesso assorbe a 540 nm).
Preparazione del reattivo per il metodo del biureto
Sciogliere 1.5 g solfato di rame (II) e 6 g tartrato di sodio e potassio in 500 mL H2O.
Aggiungervi 300 mL NaOH 10%.
Portare a volume a 1L con H2O.
Aggiungere 1 g KI (serve per inibire la riduzione del rame.
Conservare in contenitore al buio (o avvolto nell’alluminio), scartare nel caso si osservi un precipitato scuro o rossastro.
Retta di taratura con spettrofotometro
Preparare 2 mL di soluzione 10 mg/mL di BSA (albumina di siero di bovino) in H2O. Da questa preparare differenti concentrazioni secondo la seguente tabella:
|
Conc finale (mg/mL) |
Volume BSA 10 mg/mL (μL) |
Volume H2O (μL) |
|
0 |
0 |
500 |
|
0.5 |
25 |
475 |
|
1.5 |
75 |
425 |
|
3.0 |
150 |
350 |
|
5.0 |
250 |
250 |
|
8.0 |
400 |
100 |
|
10.0 |
500 |
0 |
Settare lo spettrofotometro a 540 nm. Il bianco viene effettuato con la conc. 0, ponendo in cuvetta 100 μL H2O + 500 μL reattivo biureto.
Misurare le Assorbanze delle varie concentrazioni: 100 μL diluizione BSA + 500 μL reattivo biureto, attendere 30 secondi e leggere l’Assorbanza.
Preparare una retta di taratura tra Assorbanza (y) e Conc. di BSA in mg/mL (x) tramite un foglio di calcolo Excel, con cui si può determinare l’equazione della retta di taratura y=mx+q interpolante i punti ottenuti.
Quantificazione del contenuto proteico dei campioni
Misurare l’assorbanza dei vari campioni preparando la cuvetta con 100 μL campione + 500 μL reattivo biureto, attendere 30 sec. mescolando leggermente prima della misura allo spettrofotometro.
Campioni per esempio di carne o pesce possono essere valutati pesando in una provetta circa 0,1 g (esattamente pesati) dell’omogeneizzato dell'alimento, aggiungendovi 1 mL SDS 10% e lasciando in estrazione per 1 ora. A quel punto centrifugare e valutare il solo sopranatante.
Per tali omogeneizzati, il bianco allo spettrofotometro va rifatto con 100 μL SDS 10% + 500 μL reattivo biureto.
Utilizzando la retta di taratura sarà possibile determinare le concentrazioni in mg/mL di proteine complessive nei campioni [x=(y-q)/m] considerando poi i vari fattori di diluizione utilizzati.
Categorie Articoli e Appunti
• Chimica Generale
•
Chimica Analitica
•
Chimica Inorganica
•
Chimica Organica
•
Biochimica
•
Biologia
•
Genetica