 TuttoChimica.it
TuttoChimica.it
Chimica, laboratorio e dintorni...

I legami chimici
I legami ionici, covalenti, interazioni deboli
Gli atomi in natura, fatta eccezione per i gas nobili, cioè gli elementi dell'ultimo gruppo della tavola periodica come l'Elio He, non esistono nella loro forma stabile come tali, ma legati ad altri atomi tramite legami chimici a formare molecole. Perchè gli atomi si uniscono fra loro a formare le molecole? Si è visto che gli atomi risultano energeticamente più stabili quando hanno il loro ultimo livello elettronico completo (si vedano a tal proposito gli appunti sui modellli atomici e configurazione elettronica) seguendo la regola del'ottetto. Pertanto gli atomi dei vari elementi si legano tra loro cedendo, acquistando o mettendo in comune gli elettroni di valenza, definibile anche come il numero di atomi di H che un atomo può legare a sè per raggiungere la stabilità (l'ottetto).
Il concetto è spiegabile con l'esempio del metano (CH4). Il Carbonio ha simbolo di Lewis
![]()
pertanto, legandosi a 4 atomi di idrogeno (1s1), che hanno un elettrone spaiato, raggiunge l'ottetto. L'idrogeno invece completa il suo ultimo livello e raggiunge la stabilità con 2 elettroni.
La formazione di legami chimici comporta la liberazione di energia, che corrisponde alla differenza di energia tra l'atomo singolo e l'atomo più stabile nella molecola. Allo stesso modo, per rompere un legame chimico si dovrà fornire energia: tale energia è detta energia di legame, e dipende dal tipo di atomi implicati nel legame.
Il tipo di legame che si forma dipende in gran parte dal valore di elettronegatività (la tendenza degli atomi ad attrarre a sè glielettroni, aumenta negli atomi scorrendo verso la destra della tavola periodica e anche verso il basso) dei due atomi implicati nel legame: se la differenza di elettronegatività dei due atomi è superiore a 1.7, il legame sarà di tipo ionico, cioè prevede la ionizzazione dei due atomi. Altrimenti sarà un legame con condivisione di elettroni (covalente).
Legame ionico:
Un esempio è fornito dalla molecola di NaCl (il sale da cucina).
Na: 1s2 2s2 2p2 2p6 3s1
Cl: 1s2 2s2 2p6 3s2 3p5
Na ha elettrongatività 0.96, Cl ha elettronegatività 3.0. La differenza è 2.04, quindi molto elevata. Il sodio perde facilmente il suo elettrone esterno, 'catturato' dal cloro che ha elevata elettronegatività (ha alta affinità elettronica). Quindi si avranno due ioni:
Na+: 1s2 2s2 2p2 2p6
Cl-: 1s2 2s2 2p6 3s2 3p6
In questo modo entrambi raggiungono l'ottetto nell'ultimo livello. I due ioni di segno opposto a questo punto si attraggono per via delle forze elettrostatiche che caratterizzano il legame ionico.
I composti di antura ionica hanno in genere queste proprietà: solubilizzano in acqua, dove conducono la corrente; hanno alto punto di fusione, e conducono la correnbte anche allo stato fuso; tendono di solito a cristalllizzare al diminuire della T;
Legame covalente:
Distinguiamo due tipi di legame covalente: puro e polare.
Legame covalente puro
Un esempio è la molecola di Cloro ( Cl2 ). Il Cloro mette in comune un elettrone spaiato con un altro atomo di Cloro, e raggiunge l'ottetto. Graficamente possiamo indicare la molecola con il legame covalente grazie ad un trattino che unisce i due atomi e ci indica la coppia di elettroni in comune:
![]()
Per l'ossigeno, gli elettroni in comune sono 4, e ciò si indica con un doppio legame
![]()
Legame covalente polare
Consideriamo epr esempio la molecola di HCl
H: 1s1
Cl: 1s2 2s2 2p6 3s2 3p5
l'elettronegatività è 2.2 per H e 3 per Cl, quindi la differenza è 0.8, insufficiente per il legame ionico. I due atomi condividono un elettrone e raggiungono la stabilità tramite legame covalente, ma lacoppia di elettroni non è egualmente condivisa tra i due atomi, infatti il cloro, più elettronegativo, tenderà ad attirarli con più forza. Si crea quindi una parziale delocalizzazione di carica negativa sul cloro, e di carica positiva sull'H. Questo forma il cosiddetto dipolo, e la molecola è detta molecola polare.
![]()
Tipologie di legami covalenti: σ e π
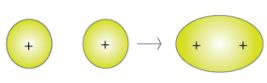
I legami covalenti possono essere di tipo sigma o di tipi pi greco, a seconda del tipo di orbitali moleolari che si formano (gli orbitali molecolari sono gli orbitali che si creano durante la formazione del legame di condivisione di elettroni). Vengono infatti a crearsi degli orbitali ibridi, e quando i legami sono frontali, ossia lungo l'asse congiunente i nuclei dei due atomi, i legami sono detti sigma, mentre se i legami si trovano lateralmente alla linea congiungente sono detti pigreco. Un legame singolo è sempre di tipo sigma, un legame doppio è costituito da un legame sigma e uno pi greco, un legame triplo invece da un legame sigma e due pi greco. Per esempio, gli orbitali s di due atomi di idrogeno si uniscono in un orbitale molecolare sigma (nelle figure, il + rappresenta i nuclei):
Analogamente per gli orbitali p che si trovano sulla linea
congiungente i nuclei di due atomi.
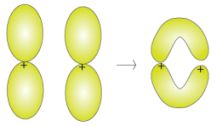
Invece la sovrapposizione laterale degli orbitali p che non si trovano
lungo la congiungente i due nuclei forma un legame pi
greco fuori dal piano contenente i due nuclei:
questo legame rende la molecola resistente alla torsione, ma è anche un legame più debole del sigma, che trovandosi più vicino ai nuclei risulta più forte.
Un esempio può essere l'azoto. La molecola è N2
N: 1s2 2s2 2p3
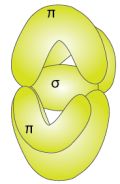
Gli elettroni di valenza sono 3, distribuiti uno per ciascuno dei 3 orbitali p. Due atomi di N possono mettere in comune i loro 3 elettroni spaiati per raggiungere l'ottetto. Uno dei tre orbitali p, quello sull'asse congiungente i nuclei dei due N, si lega con l'analogo orbitale p dell'altro atomo, con un legame di tipo sigma. Gli altri due orbitali p, perpendicolari al primo, formeranno due orbitali pi greco tra loro perpendicolari.
Il legame dativo:
In alcuni casi tra due atomi non si ha una condivisione di elettroni uno ceduto da un atomo e l'altro fornito dall'altro atomo, ma entrambi gli elettroni del legame sono forniti da un atomo che li 'dona' nel legame all'altro. E' il caso dello zolfo, che ha 6 elettroni di valenza, e si può legare all'ossigeno tramite legame dativo. Il legame dativo si indica con una freccia:
![]()
L'atomo che cede gli elettroni è detto donatore e l'altro è detto accettore.
Ibridi di risonanza e forme mesomere:
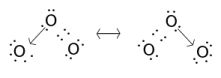
In alcuni casi, che comprendono spesso la presenza di legami dativi, è possibile scrivere la stessa molecole con più formule di struttura. E' il caso dell'ozono O3.
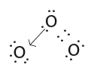
Nell'ozono due atomi di ossigeno sono legati tra loro con legame covalente,
mentre il terzo è legato ad uno dei due tramite legame dativo. E'
indifferente quale dei due atomi di ossigeno fornisce il legame dativo: si dice
pertanto che esistono due forme di risonanza o forme mesomere, ad
eguale probabilità di esistenza tra loro. In realtà non si ha nella molecola di
ozono un legame covalente e un legame dativo, ma la risultante delle due forme
di risonanza che dà due legami
uguali, misto di legame dativo e covalente.
Legame metallico:
Nei metalli (per esempio il ferro, lo zinco, il rame) la struttura è considerabile quella di un reticolo di atomi (di geometria variabile) ionizzati positivamente immersi in un 'mare' di elettroni, responsabili del carattere di conducibilità elettrica. Si stabilisce tra gli ioni e gli elettroni di valenza degli stessi atomi una forza attrattiva (legame metallico).
Legami intermolecolari o legami chimici secondari:
I legami intermolecolari sono essenziali per l'esistenza degli stati liquido e solido. Se non esistessero forze a tenere unite le molecole, esisterebbe infatti soltanto lo stato gassoso. Tali forze sono quindi responsabili anche dei passaggi di stato. Vediamole:
1. Forze di Van Der Waals o forze di dispersione di London
Si stabiliscono fra molecole non polari e neutre, come per esempio N2 , H2 .. Si tratta della formazione di dipoli momentanei all'interno delle molecole, dovute alle fluttuazioni della nube elettronica attorno alla molecola, che crea temporanee separazioni di carica (che invece in molecole polari sono costanti - è il caso del dipolo della molecola di HCl). Queste forze sono le responsabili dei passaggi di stato di questo tipo di molecole.
2. Interazioni dipolo-dipolo
Si hanno in molecole con dipoli permanenti, come HCl. Queste sostanze hanno una separazione di carica dovuta alla differenza di elettronegatività degli atomi costituenti le molecole, e i dipoli delle singole molecole interagiranno con tutti i dipoli delle altre molecole, creando una rete di interazioni energetiche stabilizzanti. Queste sostanze avranno quindi punti di fusione e di ebolizione maggiori rispetto a molecole apolari.
Il legame a idrogeno è un particolare tipo di interazione dipolo-dipolo, che si ha quando atomi di idrogeno sono legati ad atomi fortemente elettronegativi (O, F, N). Si crea una carica parziale positiva sull'idrogeno e negativa sull'atomo elettronegativo. La molecola risulta fortemente polarizzata e gli atomi di H creeranno una fitta rete di interazioni con gli altri atomi elettronegativi presenti sulle altre molecole. Questi legami (che vengono rappresentati con un tratteggio tra l'atomo di H e gli atomi elettronegativi) sono molto forti e rendono i punti di fusione e di ebollizione delle sostanze in cui si formano ancora più elevati (per es. HF ha temperatura di ebollizione molto più alta di HCl. Anche nell'acqua i legami a idrogeno sono responsabili della T di ebollizione di 100°C).
3. Interazioni dipolo-dipolo indotto
Una molecola con dipolo permanente posta vicino ad una molecola apolare ne induce la formazione di un dipolo (appunto un dipolo indotto), poichè l'estremità negativa del dipolo permanente sposta la nube eletttronica della molecola apolare per repulsione, generando un nuovo dipolo.
Categorie Articoli e Appunti
• Chimica Generale
•
Chimica Analitica
•
Chimica Inorganica
•
Chimica Organica
•
Biochimica
•
Biologia
•
Genetica