 TuttoChimica.it
TuttoChimica.it
Chimica, laboratorio e dintorni...

Atomi ed Isotopi
Il nucleo, gli elementi, la tavola periodica, gli isotopi
Un atomo è costituito da un nucleo centrale, costituito da neutroni (di carica neutra) e protoni (di carica positiva), attorno al quale ruotano gli elettroni (di carica negativa).
Il numero di protoni è uguale al numero di elettroni, in questo modo l'atomo risulta complessivamente di carica neutra. Gli elettroni sono molto più piccoli di neutroni e protoni: nella seguente tabella sono riportati i pesi in unità di massa aomiche di protoni, neutroni ed elettroni (1 u.m.a è definita come la dodicesima parte della massa dell'atomo di Carbonio che ha 6 protoni e 6 neutroni nel nucleo -- quantitativamente in un grammo ci sono 6,022 x 1023 u.m.a, numero noto come Numero di Avogadro)
| Particella | Carica | Massa (u.m.a.) |
| Protoni | +1 | 1,00728 |
| Neutroni | 0 | 1,00867 |
| Elettroni | -1 | 0,000549 |
Nei calcoli di massa atomica quindi si può generalmente trascurare la massa degli elettroni.
Il raggio atomico è generalmente compreso tra 1 e 2,5 Angstrom (1Å = 10-10 m). Il nucleo risulta quindi una parte molto molto piccola in proporzione alle dimensioni dell'atomo: tra nucleo ed elettroni risulta in proporzione circa la distanza che c'è tra la terra ed il Sole. Quindi per la maggior parte gli atomi sono al loro interno vuoti.
Il numero atomico (Z) è il numero di protoni di un atomo (quindi uguale anche al numero degli elettroni).
Il numero di massa (A) di un atomo è definito come la somma del numero di protoni (Z) + il numero di neutroni (N). Quindi vale:
A = Z + N
Tutti gli atomi aventi lo stesso numero atomico si comportano chimicamente allo stesso modo e vengono quindi a costituire lo stesso ELEMENTO CHIMICO. Gli elementi chimici sono catalogati nella tavola periodica: ognuno ha un nome ed un simbolo costituito da una o due lettere (per esempio, il Calcio è Ca, il sodio Na, il carbonio C).
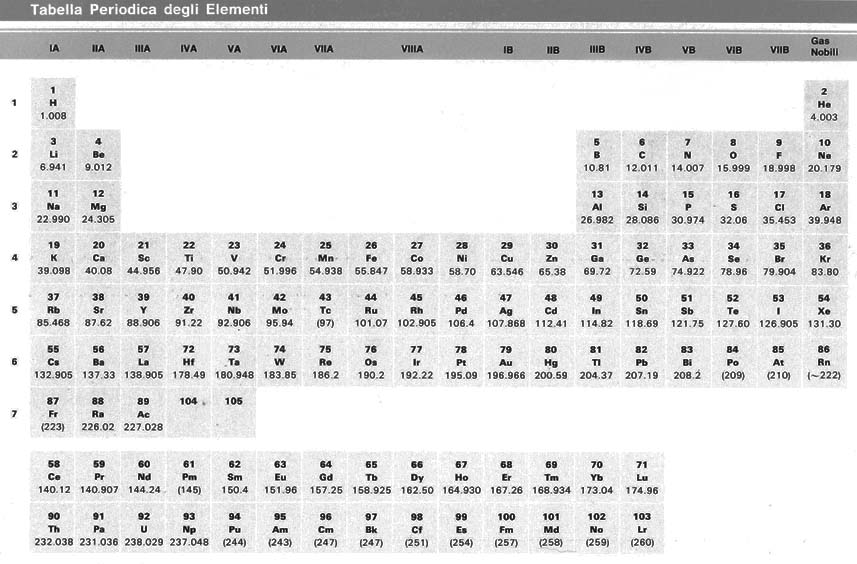
Anche se tutti gli atomi dello stesso elemento hanno ugual numero di protoni, possono tuttavia differire per il numero di neutroni. Questi atomi sono tra loro detti isotopi. Gli isotopi vengono indicati in questo modo, per esempio per l'Uranio 235U e 238U (l'Uranio ha numero atomico 92), per il Cloro 35Cl e 37Cl (Cl ha numero atomico 17). Generalmente, all'aumentare del numero atomico l'isotopo più stabile (e quindi in natura il più diffuso) ha un numero di neutroni via via sempre superiore rispetto al numero di protoni.
La massa totale di un atomo è detta peso atomico: il peso atomico è dato quindi dalla somma dei pesi di protoni + neutroni + elettroni dell'atomo. In realtà la massa differisce leggermente, in quanto parte della massa viene persa in Energia, quando neutroni, protoni ed elettroni si combinano insieme a formare l'atomo infatti una parte di massa si trasforma in Energia (l'Energia utilizzata dalle reazioni di fusione nucleare).
Il peso atomico naturale invece tiene conto dell'esistenza in natura degli isotopi a differenti %. Il peso atomico naturale sarà infatti la media pesata dei pesi atomici dei singoli isotopi moltiplicati per la loro percentuale di abbondanza relativa in natura. Per es., il Magnesio (num. atomico 12) ha 3 isotopi, al 78,70%, 10,13% e 11,17% di esistenza in natura, rispettivamente con numero di massa 24, 25 e 26. Il peso atomico medio sarà dato Generalmente si utilizza il peso atomico senza considerare questo calcolo.
Categorie Articoli e Appunti
• Chimica Generale
•
Chimica Analitica
•
Chimica Inorganica
•
Chimica Organica
•
Biochimica
•
Biologia
•
Genetica